肿瘤干性样细胞群体被认为参与了包括膀胱尿路上皮癌在内的大多数癌症的耐药和复发过程。其干性受到肿瘤内在和外部信号的协同调控。作为肿瘤微环境(Tumor microenvironment)中主要的细胞成分之一,肿瘤相关成纤维细胞(Cancer-associated fibroblast,CAF)参与了肿瘤的耐药和复发过程。虽然CAF的促癌作用已有报道,但是近期在胰腺癌和乳腺癌中,科学家发现了特定的CAF亚群具有意想不到的抑癌或者改善治疗疗效的作用。此外,最新的单细胞测序结果也揭示CAF含有性质各异的不同亚群,提示了其异质性特征。在膀胱癌中是否也存在促进或抑制化疗耐药特征的CAF?能否可从肿瘤微环境中CAF的角度来解读肿瘤微环境参与调控化疗耐药的过程?能否从中找到膀胱癌耐药复发的分子标志物或者潜在的治疗靶标?
继2021年末在Cancer Research杂志上报道了高胆固醇血症病患血清中ox-LDL作为一种外在系统性的调控肿瘤干性样细胞的重要因子,为肿瘤宏环境(Tumor macroenvironment)作用于肿瘤干性调控提供了一个有力例证之后,复旦大学实验动物科学部严俊课题组、中国科学院上海药物研究所黄锐敏课题组、南京大学附属鼓楼医院郭宏骞主任团队再度携手合作,在2023年5月15日出版的Cancer Research杂志上联袂发表了题为“Cancer-associated fibroblast-derived miR-146a-5p generates a niche that promotes bladder cancer stemness and chemoresistance”的研究论文,报道了膀胱癌微环境中miR-146a-5p高表达的CAF能调控肿瘤细胞干性,进而促进肿瘤对吉西他滨/顺铂联合化疗的耐药。
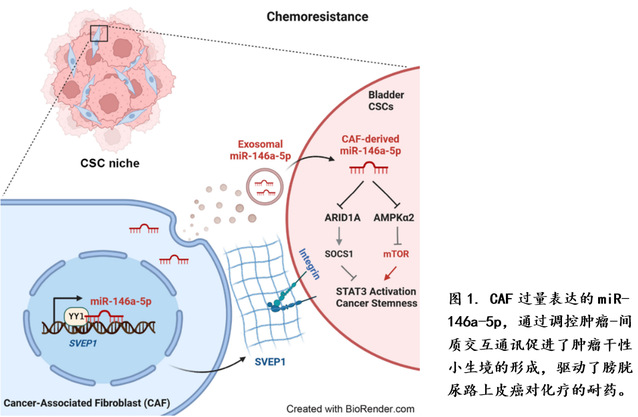
在此项研究中,研究人员通过比较原代培养的膀胱癌CAF和癌旁组织来源的成纤维细胞(NF),发现CAF能较强地促进膀胱肿瘤细胞的体内和体外的耐药能力。miRNA表达谱分析和体内功能实验验证了CAF中过量表达miR-146a-5p促进膀胱癌耐药。进一步结合mRNA表达谱以及功能实验,作者阐明了CAF中核定位的miR-146a-5p可以调控编码胞外基质蛋白的SVEP1基因的转录,其作用机制为miR-146a-5p通过结合SVEP1基因的内含子区段,增加转录因子YY1的招募,上调SVEP1的转录水平,从而促进了CAF对膀胱癌细胞的黏附。另一方面,CAF中过量表达的miR-146a-5p亦可借助外泌体的旁分泌途径被膀胱癌细胞摄取后,靶向ARID1A和AMPKα2的3’UTR来降低它们的表达水平。下调的ARID1A 可以通过SOCS1激活STAT3,而下调的AMPKα2可以导致mTOR信号通路的活化。最终,两者合力提高了膀胱癌的肿瘤干性(图1)。以上结果展示了CAF来源的miR-146a-5p通过对自身及周边的肿瘤细胞的调控,形成了维持肿瘤干性的小生境(niche)。
该研究揭示了膀胱癌在吉西他滨/顺铂联合治疗中CAF过量表达miR-146a-5p是膀胱癌产生耐药的重要原因,提出了支撑肿瘤细胞干性的小生境形成机制,解析了miR-146a-5p促进膀胱癌化疗耐药的双重调控途径,提示了miR-146a-5p作为膀胱癌化疗耐药的分子标志物和靶标的潜力。
该研究工作获得了复旦大学于文强教授和中国科学院上海药物研究所任进研究员的指导,并获得了国家基金委、上海市科委、上海市扬帆计划和江苏省自然基金委等的项目支持。
论文链接:https://aacrjournals.org/cancerres/article-abstract/83/10/1611/726305
