一 小胶质细胞在老龄化过程中起关键作用
老龄化是脑疾病发生的风险因素之一1。小胶质细胞是中枢神经系统(CNS)内的固有免疫细胞,在维持CNS稳态、突触修剪2、神经元兴奋性调控3及血脑屏障(BBB)维持4等多个过程中都起至关重要的作用。在机体老龄化的过程中,小胶质细胞持续监视CNS内环境的变化,并在遇到“危险”时迅速做出反应。研究表明老年个体脑内的小胶质细胞的监视及吞噬功能有下降趋势5,功能异常的小胶质细胞会加剧神经退行性变,并引起神经元、少突胶质细胞等出现功能紊乱6。此外,小胶质细胞在接受免疫刺激时会形成免疫记忆,在第二次接受相似的免疫刺激时会形成更快速、更剧烈的免疫反应,这种现象称为“启动效应(priming)”7,8。由于老年脑内的小胶质细胞更有可能在早期生命进程中接受更多的免疫刺激,从而更易呈现出“primed”状态。已有研究表明,“primed microglia”会加速阿尔兹海默症脑内淀粉样蛋白Aβ的聚集9。此外,α-突触核蛋白引起的“microglial primed”会产生更多的促炎因子以及活性氧(ROS)10。
这些证据表明小胶质细胞与脑相关疾病存在密切关联,系统性解析小胶质细胞的老龄化特征和并阐明老龄化小胶质细胞对机体的作用机制,对理解机体的衰老进程和脑疾病的发病机制至关重要。然而,小胶质细胞在老龄化过程中转录组和表观遗传的变化仍不完全清楚。饶艳霞/彭勃研究团队绘制了小胶质细胞老龄化图谱(衰老图谱),并开发3xDR模型在非老龄化小鼠脑内引入老龄化的小胶质细胞,首次解析了单一类型细胞的衰老对机体的影响。
二 饶艳霞/彭勃团队系统性解析小胶质细胞的老龄化进程,并开发3xDR模型,可以在非老龄化动物体内研究老龄化小胶质细胞
复旦大学饶艳霞和彭勃团队长期专注于小胶质细胞更替的研究。该团队前期系列研究工作阐明了小胶质细胞在更替过程中死亡细胞碎片的清除机制(Nature Communications, 2022)11以及新生小胶质细胞的起源和迁移机制(图1)(Nature Neuroscience, 2018和Cell Discovery, 2018)12,13,并以此为基础开发了3种不同的小胶质细胞替换策略(图1)(Cell Reports, 2020)14,为神经系统疾病提供了新的治疗思路和可临床实现的方案。此外,该团队进一步发现NeuroD1可通过BCL2途径介导小胶质细胞凋亡,提出可利用该途径作为分子开关(switch-off control),增强小胶质细胞替换疗法的安全性(Neuron, 2021)15(图1)。该团队在其前期研究的基础上,利用多种研究手段,进一步解析了小胶质细胞的老龄化进程,并首次在非老龄化的动物脑内引入了老龄化细胞,为解析老龄化小胶质细胞对机体的影响提供重要研究手段。该研究成果以Transcriptional and epigenetic decoding of the microglial aging process为题于2023年9月11日发表在Nature Aging上(图1-2)(Nature Aging, 2023)16。

图1 饶艳霞/彭勃团队近年来围绕小胶质细胞更替取得的代表性学术成果。

图2 论文首页
该团队首先通过RNA-seq检测2至24月龄雄性和雌性小鼠的小胶质细胞转录组学特性。结果显示不同性别小鼠的小胶质细胞展现出不同的老龄化进程。雌性小鼠的小胶质细胞随年龄增加呈渐进性变化,表现出青年、中年和老年三个时期。而雄性小鼠的小胶质细胞则在8-12月龄时出现“断崖式”的突变,立即从青年时期发展到老年状态。此外,该团队还发现有一类基因与年龄有密切的相关性,这类基因会随年龄的增加持续上调/下调,该团队将这类与年龄密切相关的基因定义为Age-dependent microglia(ADEM)基因。其中随着年龄持续上调的基因定义为P-ADEM基因,而随着年龄持续下调的基因定义为N-ADEM。该团队还进一步借助scRNA-seq技术以及ATAC-seq技术从更高分辨率的转录组学层面及表观遗传学层面对小鼠小胶质细胞在老龄化过程中的特性以及ADEM的有效性进行了验证。结果显示scRNA-seq的结果与RNA-seq的数据具有良好的一致性,且ADEM基因相关区域的染色质开放程度有明显增加。
传统的观点认为老年脑内的“primed microglia”在经受第二次刺激时会产生更强的免疫反应8,17。然而,老年动物的小胶质细胞在经历免疫刺激时在转录组学及表观遗传学层面是否会产生更激烈的改变尚不清楚。该团队分别对青年、中年和老年的小鼠给予LPS刺激,并观察不同年龄小鼠小胶质细胞在转录组学及表观遗传学层面的变化。与传统认知不同,该团队的研究结果表明老年小胶质细胞在LPS刺激下的响应要弱于青年小胶质细胞。
在既往的衰老研究中,是在老龄化的小鼠中研究具体的老龄化细胞的功能。然而机体的老龄化是复杂的,不同的老龄化细胞相互作用,所观察到的现象是某类老龄化细胞与老龄化机体中其他老龄化细胞相互作用后的结果,难以解析单一类型细胞的老龄化对机体的影响。该研究团队开发了3xDR模型,通过加速小胶质细胞更替,使小胶质细胞展现出老龄化状态。该方法首次实现在非老龄化小鼠中引入了老龄化小胶质细胞,以此研究小胶质细胞这一单一细胞类型的老龄化对机体的影响。利用3xDR模型发现,小胶质细胞的老龄化能够引起小鼠认知功能的衰退和皮层神经元的髓鞘丢失。
因此,该研究团队绘制了小胶质细胞老龄化图谱(衰老图谱),并利用转录组学、表观遗传学、药理学、组织学和行为学等多种研究手段,系统性解析了小胶质细胞的老龄化进程(图3)。为帮助领域内研究人员获取相关数据,该团队建立了小胶质细胞图谱网站(http://www.microgliatlas.com),可在该网站检索本研究工作所获取的组学数据(图4)。
Nature Aging同期对该研究刊发了Research Briefing(研究简报),加拿大维多利亚大学Marie-Ève Tremblay教授撰写评论,认为该研究非常有价值,增进了人们对小胶质细胞老龄化及其如何影响记忆的理解(This represents a highly relevant paper that improves our understanding of microglial aging and its impact on memory)。
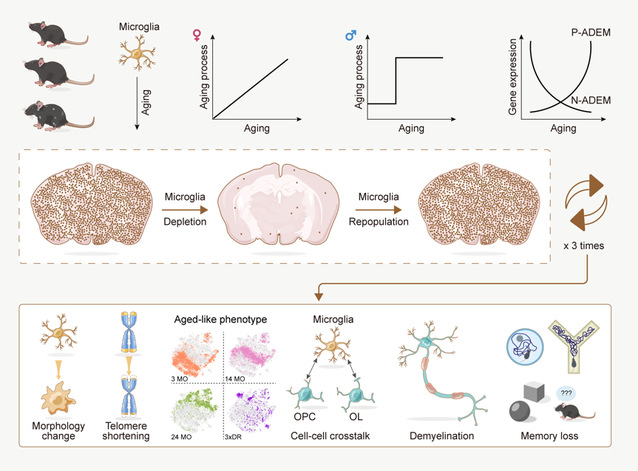
图3 本研究主要结论的总结图。
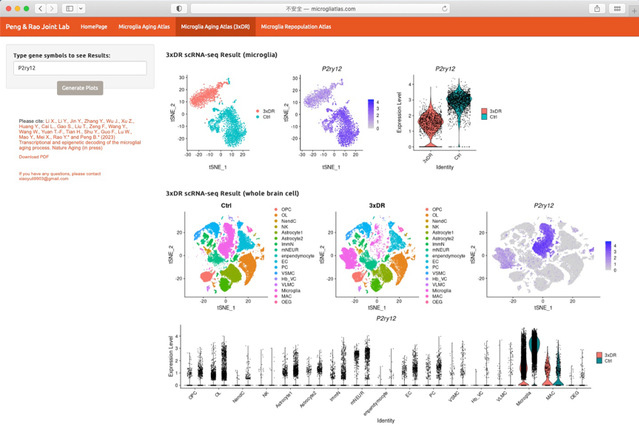
图4 小胶质细胞图谱网站(http://www.microgliatlas.com)。
复旦大学饶艳霞和彭勃教授是本论文的通讯作者,直博生李小钰同学为第一作者,团队成员李雨欣、金玉晓、张煜恒、吴精川、徐臻、黄玉斌、蔡霖、高帅、刘陶慧、曾凡卓、王亚飞和王文旭共同参与。本研究得到了复旦大学/浙江大学段树民院士、复旦大学舒友生教授、郭非凡教授、陆巍教授、上海市精神卫生中心袁逖飞教授、上海市第六人民医院田恒力教授等学者的帮助。该研究在脑科学与类脑研究(中国脑计划)重大研究计划、国家自然科学基金、教育部科技领军人才团队、上海市基础研究学术特区、上海市曙光计划、上海市优秀学术带头人等项目的资助下完成。
论文全文https://www.nature.com/articles/s43587-023-00479-x。
饶艳霞/彭勃课题组目前有青年研究员(教授)、青年副研究员(副教授)、博士后和实验室管家等岗位,欢迎对科研充满热情且胸怀学术理想的科研人员/同学加入。申请人请将一份详细的个人完整简历(中英文皆可)通过电子邮件发送至yanxiarao@fudan.edu.cn,邮件标题请注明姓名+应聘职位。青年研究员、青年副研究员和博士后应聘者请提供2~3位推荐人的联系方式。
通讯作者饶艳霞介绍:
国家万人计划青年拔尖人才,科技创新2030脑科学与类脑研究(中国脑计划)青年科学家项目首席科学家,上海市领军人才(海外),上海市超级博士激励计划、以及香港政府奖学金获得者,博士生导师。主要关注衰老与中枢免疫、外周免疫对中枢免疫的调控。研究工作以通讯作者或第一作者发表在Nature Neuroscience, Nature Aging, Neuron, Cell Reports, Cell Discovery和Ageing Research Reviews等高水平期刊。
参考文献
1. Hou, Y. et al. Ageing as a risk factor for neurodegenerative disease. Nat Rev Neurol15, 565-581 (2019).
2. Hong, S., Dissing-Olesen, L. & Stevens, B. New insights on the role of microglia in synaptic pruning in health and disease. Curr Opin Neurobiol36, 128-34 (2016).
3. Badimon, A. et al. Negative feedback control of neuronal activity by microglia. Nature (2020).
4. Ronaldson, P.T. & Davis, T.P. Regulation of blood-brain barrier integrity by microglia in health and disease: A therapeutic opportunity. J Cereb Blood Flow Metab40, S6-S24 (2020).
5. Safaiyan, S. et al. White matter aging drives microglial diversity. Neuron (2021).
6. Shahidehpour, R.K. et al. Dystrophic microglia are associated with neurodegenerative disease and not healthy aging in the human brain. Neurobiol Aging99, 19-27 (2021).
7. Perry, V.H. & Holmes, C. Microglial priming in neurodegenerative disease. Nat Rev Neurol10, 217-24 (2014).
8. Norden, D.M., Muccigrosso, M.M. & Godbout, J.P. Microglial priming and enhanced reactivity to secondary insult in aging, and traumatic CNS injury, and neurodegenerative disease. Neuropharmacology96, 29-41 (2015).
9. Krstic, D. et al. Systemic immune challenges trigger and drive Alzheimer-like neuropathology in mice. Journal of Neuroinflammation9, 151 (2012).
10. Codolo, G. et al. Triggering of inflammasome by aggregated α-synuclein, an inflammatory response in synucleinopathies. PLoS One8, e55375 (2013).
11. Zhou, T. et al. Microglial debris is cleared by astrocytes via C4b-facilitated phagocytosis and degraded via RUBICON-dependent noncanonical autophagy in mice. Nat Commun13, 6233 (2022).
12. Huang, Y. et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature Neuroscience21, 530-540 (2018).
13. Huang, Y. et al. Dual extra-retinal origins of microglia in the model of retinal microglia repopulation. Cell Discov4, 9 (2018).
14. Xu, Z. et al. Efficient strategies for microglia replacement in the central nervous system. Cell Rep32, 108041 (2020).
15. Rao, Y. et al. NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming. Neuron109, 4094-4108.e5 (2021).
16. Li, X. et al. Transcriptional and epigenetic decoding of the microglial aging process. Nature Aging (2023).
17. Niraula, A., Sheridan, J.F. & Godbout, J.P. Microglia Priming with Aging and Stress. Neuropsychopharmacology42, 318-333 (2017).
